Экзокринная панкреатическая секреция подразделяется на межпищеварительную и пищеварительную. Межпищеварительная экзокринная секреция осуществляется циклически. Каждый цикл длится около 90 мин и координирован с моторикой желудочно-кишечного тракта, секрецией желудком кислоты, сокращением желчного пузыря. I фаза характеризуется отсутствием моторики двенадцатиперстной кишки и секреторной активности поджелудочной железы, желудка и поступления желчи. Во II фазе секреция и моторная активность нарастают, достигая максимума непосредственно перед III фазой, которая представляет собой 5-10-минутный период сократительной активности, следующей вниз по пищеварительному тракту. IV фаза представляет собой кратковременную нерегулярную активность, переходящую в состояние покоя.
Прием пищи преобразует межпищеварительную периодическую панкреатическую секрецию в постоянную секрецию, которая на 75 % превышает максимальный уровень секреции в конце II фазы (E. P. DiMAGNO, 1989 г.).
Ферменты панкреатического сока, участвующие в переваривании пищи, выделяются ацинозными клетками. Эти клетки синтезируют ферменты из аминокислот, глюкозы, липидов и других элементов, поступающих к ним с кровью и лимфой. Синтез белка в ацинозных клетках происходит постоянно, даже в покое ферменты ритмично выделяются в систему протоков. Поджелудочная железа содержит около 3 г ферментных белков.
Панкреатические ферменты подразделяются на амилолитические, протеолитические, липолитические и нуклеолитические.
Альфа-амилаза расщепляет крахмал и гликоген до дисахаридов, которые далее трансформируются с помощью инвертазы, мальтазы и лактазы до соответствующих моносахаридов.
К панкреатическим ферментам, участвующим в липолизе, относят липазу (гидролиз триглицеридов), фосфорилазу А (гидролиз фосфолипидов) и карбоксилэстеразу (гидролиз эфиров жирных кислот).
Протеолитические ферменты синтезируются ацинозными клетками в виде проферментов, которые активируются в кишечнике. Так, трипсиноген под воздействием энтерокиназы активируется до состояния трипсина. Аналогичные превращения происходят и с другими эндопептидазами – химотрипсиногенами, проэластазами и экзопепетидазами – карбоксипептидазами, аминопептидазами и другими белками (например, калликреиногеном).
К нуклеолитическим ферментам панкреатического сока относятся фосфодиэстеразы – рибонуклеаза (гидролиз рибонуклеиновой кислоты) и дезоксирибонуклеаза.
Кроме того, в панкреатическом соке обнаруживаются и другие белки, не играющие роли в пищеварении: секреторный и иммуноглобулин А, карциноэмбриональный антиген, лактоферрин и др.
Секреция кислых мукополисахаридов эпителием протоков в физиологических условиях защищает эпителий от влияния ферментов.
Секреция электролитов, воды и гидрокарбоната осуществляется преимущественно в дистальных отделах протоков. Источником синтеза гидрокарбонатов является углекислый газ крови и воды с помощью карбоангидразы в клетках эпителия вставочных отделов и других мелких протоков поджелудочной железы. Гидрокарбонаты диффундируют через эпителий из-за разницы потенциалов между протоками и кровью, а в обратном направлении диффундируют хлориды. Максимальная концентрация гидрокарбоната в дуоденальном содержимом составляет 100–150 ммоль/л.
"Натриевый насос" обеспечивает диффузию ионов натрия из эпителия протоков в состав панкреатического сока, а ионов водорода в кровь. Натрий составляет 95 % всех катионов панкреатического сока. Концентрация калия в панкреатическом соке приблизительно такая же, как и в плазме крови.
Секреция воды происходит пассивно по разнице осмотического давления в крови – чем больше осмотическое давление в протоках, тем больше в них поступает воды из крови.
Регуляция экзокринной функции поджелудочной железы осуществляется взаимодействием нервных и гормональных механизмов.
Парасимпатическая часть вегетативной системы стимулирует секрецию поджелудочной железы. Холинергические волокна в составе блуждающих нервов подходят к поджелудочной железе непосредственно и через чревный узел, а также в виде ветвей от двенадцатиперстной кишки, обеспечивая таким образом структурно-энтеропанкреатический рефлекс секреции. Адренергические нервы ингибруют секрецию, снижая ток крови в сосудах железы (норадренолин тормозит панкреатическую секрецию, сужая сосуды) и напрямую влияя на ацинозные клетки. (VaysseN., Chayvialle J. F., Pradayrol L. Et al., 1981 г.)). Кроме того, существует пептидергические влияния на структуры поджелудочной железы, приводящие к стимуляции и ингибированию секреции. В пептидергическую систему входят нервные волокна и ганглионарные клетки, которыми вырабатываются биологически активные пептиды – вазоактивный интестинальный полипепетид (ВИП), холецистокинин, панкреатический полипептид (ПП) и др.
Активное участие в регуляции панкреатической секреции принимают гормоны (гастроинтестинальные). Одни из них стимулируют, другие (избирательно или совместно) тормозят секрецию белка и бикарбоната (табл. № 1).
Таблица № 1. Гоморальная регуляция экзокринной панкреатической секреции (Г. Р. Гринберг, 1989 г.).
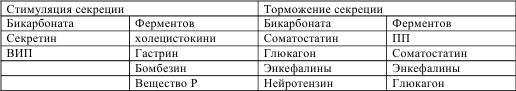
Рефлексы и гормоны определенным образом влияют на секреторную функцию поджелудочной железы в каждой фазе процесса – центральной, желудочной и кишечной. В центральной фазе, как и в фазе желудочной, поджелудочной железой выделяется панкреатический сок, богатый ферментами и содержащий относительно мало воды, гидрокарбоната и электролитов. Объясняется данный факт влиянием на ацинозные клетки парасимпатической активацией и гастрина.
В кишечной фазе поступление хлористоводородной кислоты и продуктов переваривания пищи в двенадцатиперстную кишку ведет к выбросу гастроинтестинальных гормонов (эндогенных полипепетидов), обладающих широким спектром биологической активности. В частности, происходит выделение холецистокинина и секретина. Секретин и холецистокинин действуют, потенцируя друг друга. Под их влиянием происходит изменение содержания панкреатического сока в сторону усиления присутствия в нем бикарбоната, воды и электролитов.
Желчь, попадая в двенадцатиперстную кишку, стимулирует панкреатическую секрецию. Секретин и холецистокинин являются в свою очередь стимуляторами выделения желчи. Физиологическим торможением процесса секреции поджелудочной железы является прекращение опорожнения желудка. Тормозные импульсы возникают в подвздошной и толстой кишке, когда прекращается всасывание воды и электролитов (Harper, Scratcherd, 1979 г.).
Эндогенная функция поджелудочной железы определяется функционированием клеток островков Лангерганса: альфа-клетками, бета-клетками и дельта-клетками.
Глюкагон активирует гликогенолиз в сердечной мышце и печени, стимулирует глюконеогенез, а также триглицеридлипазную активность в жировой ткани, что приводит к мобилизации жирных кислот. Глюкагон также увеличивает поступление аминокислот в печень.
Инсулин усиливает транспорт глюкозы через мембрану мышечных клеток. Инсулин стимулирует биосинтез белка, углеводов и жиров. Инсулин увеличивает скорость синтеза РНК в мышцах. Со стимуляцией гликогенеза и липогенеза происходит понижение уровня глюкозы в сыворотке крови. Абсолютный или относительный недостаток инсулина является причиной сахарного диабета.
Соматостатин тормозит секрецию глюкагона и инсулина. (Waldhause et al., 1977 г.). Его секреция стимулируется глюкозой, аргинином, лейцином, кальцием, холецистокинином и глюкагоном, тормозится адреналином. Недостаточное выделение соматостатина приводит к усиленному всасыванию пищи и гипергликемии, а затем и гипергликемии (Orci, Unger, 1975 г.).
Болезни желудка и двенадцатиперстной кишки
Язвенная болезнь желудка
Язвенная болезнь желудка – хроническое, циклически протекающее заболевание с разнообразной клинической картиной и характеризующееся возникновением в период обострения изъязвления слизистой оболочки желудка.
Несмотря на отсутствие точных статистических данных, в последние десятилетия наблюдается несомненный рост числа заболеваний язвенной болезнью среди населения.
По статистическим данным язвенная болезнь встречается в 8-10 % случаев среди мужского населения, на 1000 населения приходится 8,2 больного язвенной болезнью мужчины и 2 женщины.
Рост заболеваемости язвенной болезнью связывают с урбанизацией, нерегулярным питанием, загрязнением внешней среды и развитием тканевой гипоксии. Вторая мировая война оказала несомненное влияние на увеличение числа случаев язвенной болезни.
Заболевание встречается в любом возрасте но чаще в 30–40 лет. В последние десятилетия установлено, что язвенная болезнь нередко встречается в юношеском и детском возрасте. Убедительных данных о взаимосвязи между профессией и язвенной болезнью не имеется.
Этиология
К факторам риска, способствующим язвообразованию, можно отнести конституционально-наследственные особенности (0 группа крови, HLA-B5 антиген, снижение активности a1-антитрипсина), инфицирование Helicobacter pylori, стрессовые ситуации, курение, употребление алкоголя, а также некоторых лекарственных препаратов (нестероидных противовоспалительных препаратов, глюкокортикоидов, химикатов) и другие факторы.